单细胞技术揭示小鼠脊髓损伤过程中的室管膜细胞变化
2023年1月英国邓迪大学通过单细胞转录组测序(scRNA-seq)绘制成年和老年小鼠的脊髓室管膜细胞的单细胞图谱,揭示了小鼠脊髓损伤过程中的室管膜细胞变化。这种对脊髓室管膜细胞的深入表征提供了对其生物学的深入了解,并为脊髓修复策略提供了信息。

下面跟着元小新一起学习充电吧~
文章亮点
01
用单细胞技术解决了什么问题?
利用单细胞测序鉴定成年和老年小鼠脊髓中的室管膜细胞特征。
02
实验亮点
通过研究成年和老年小鼠脊髓中室管膜细胞转录组,证明了脊髓室管膜细胞和年龄相关变化。脊髓和脑室管膜细胞的单细胞测序结果比较,解释了脊髓和大脑室管膜细胞成熟和增殖能力差异。
03
临床意义
小鼠脊髓室管膜单细胞转录组学分析以及人类脊髓室管膜细胞的研究,提供了对其生物学的深入了解,并为脊髓修复策略提供了信息。
研究背景
室管膜细胞是排列在脑和脊髓中央管内的纤毛细胞。尽管在成年小鼠大脑中已经确定室管膜细胞是有丝分裂后的,但是部分脊髓室管膜细胞具有神经干细胞的功能。室管膜细胞是异质性的,一些单细胞研究集中在脊髓室管膜细胞的一个亚群上,但没有深入研究它们的异质性。小鼠室管膜细胞多样性是否反映了不同的功能和再生能力仍然未知。人类脊髓室管膜细胞也表现出异质性,并随着年龄的增长而发生巨大变化。人类和小鼠脊髓室管膜细胞随年龄增长而经历的分子变化知之甚少。
文章通过单细胞测序(scRNA-seq)生成小鼠脊髓室管膜细胞的单细胞图谱,鉴定所有已知亚型以及未成熟和成熟细胞状态。鉴定未成熟室管膜细胞作为潜在的脊髓干细胞,以及脊髓损伤诱导细胞成熟短暂逆转,并揭示成年小鼠和人类脊髓室管膜细胞的差异。
思维导图

研究结果
1、脊髓中央管区域的细胞图
为了全面表征脊髓室管膜细胞,文章采用了scRNA-seq分析小鼠脊髓中央管区域细胞(图1A,B)。鉴定出11种主要细胞类型,其中,小胶质细胞是类型最丰富的细胞,其次是室管膜细胞(图1C)。基因差异表达分析发现Ecrg4和Mia是在室管膜细胞中表达最丰富的两个基因(图1D)。

2、小鼠脊髓中的室管膜细胞具有转录异质性
为了详细探索室管膜细胞异质性,进一步对室管膜细胞进行细分。聚类显示6种室管膜细胞亚型(图2A)。
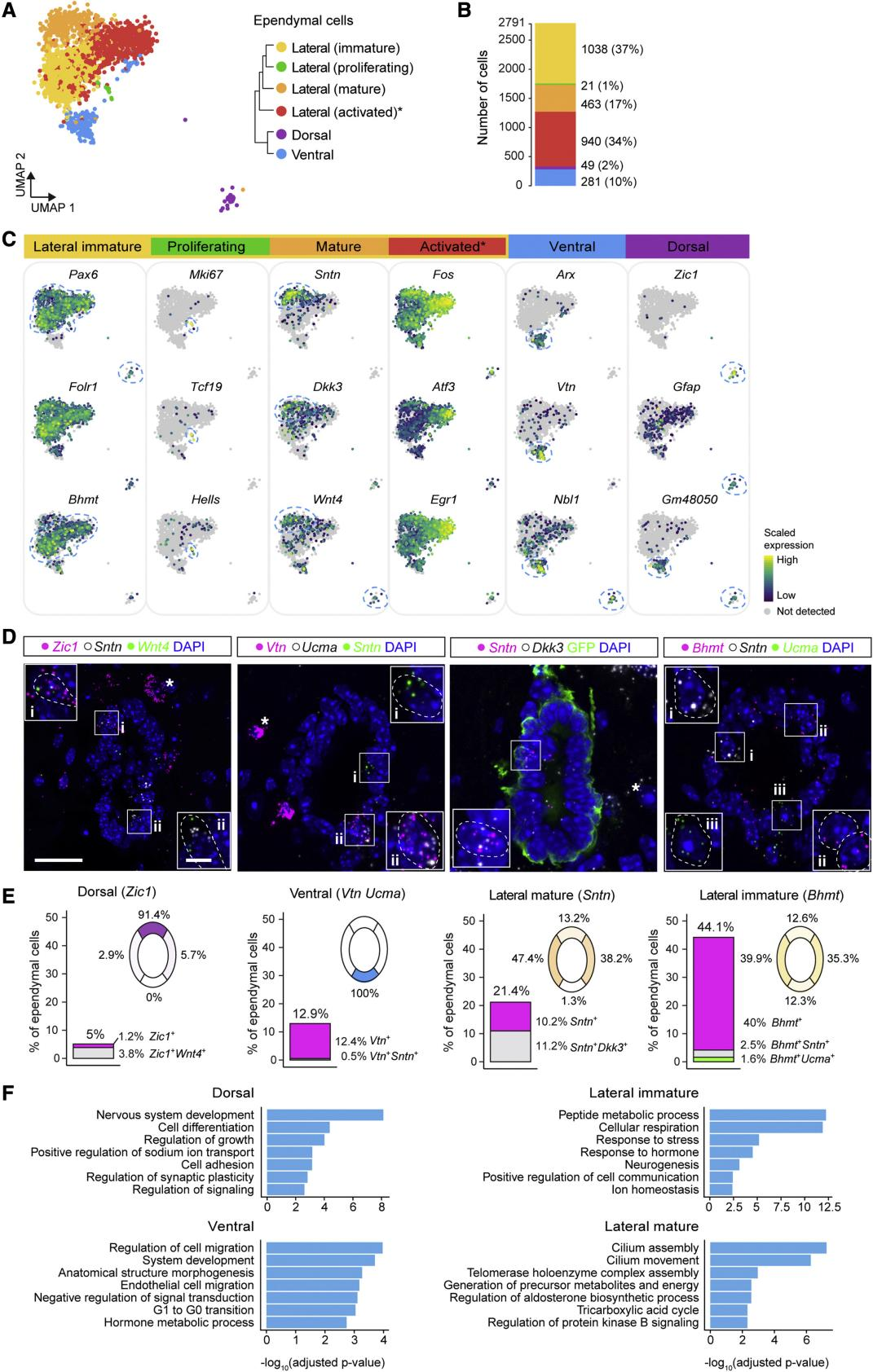
背侧室管膜细胞表达Zic1,GO富集分析其生物学过程包括神经系统发育,细胞分化,生长调节,信号传导调节(图2C,F);这些细胞可能与神经元相互作用。腹侧室管膜细胞表达Arx以及细胞粘附和扩散因子Vtn,GO分析表明其生物学过程包括细胞迁移调控,信号转导负调控,G1-G0过度等(图2F);推断腹侧室管膜细胞是静止或有丝分裂后的细胞。外侧室管膜细胞分为四种细胞状态(图2A),其中成熟的外侧室管膜细胞表达Sntn(纤毛上皮中成熟细胞的标志物);未成熟的外侧室管膜细胞表达Bhmt,并证实Bhmt阳性Sntn阴性细胞构成了中央管中的大多数细胞(图2E)。以上脊髓室管膜细胞普查捕获了所有已知室管膜细胞亚型的转录组,并揭示了外侧室管膜细胞的未成熟和成熟细胞状态。
3、成熟脊髓室管膜细胞的比例随着年龄的增长而增加
有报道表明室管膜细胞增殖和发挥神经干细胞功能的能力随着时间推移而下降。为了研究室管膜细胞如何随着年龄增长的变化,分别对老年(18-19月)小鼠和成年(3-4月)小鼠的中央管区域进行单细胞测序,表现出与年龄相关的异质性(图3B,C)。对老年和成年小鼠室管膜细胞亚型相对丰度的分析表明,与成年小鼠相比,老年小鼠外侧室管膜细胞向成熟细胞状态转变。相比之下,背侧和腹侧室管膜细胞的百分比在出生后没有变化(图3D)。
为了进一步验证,使用RNAscope研究了室管膜细胞亚型的maker在不同年龄范围内的表达(图3E)。E18.5时,只有约3%的室管膜细胞表达Sntn。随着年龄增长表达Sntn细胞的百分比逐渐增加(图3E,F)。综上所述,随着年龄增长外侧室管膜细胞群逐渐转变为更成熟的细胞状态,表明脊髓中的室管膜细胞成熟贯穿整个生命过程。

4、脊髓室管膜细胞与脑室管膜的异质性
虽然一些脊髓室管膜细胞增殖并可以产生专门的细胞来应对损伤,但是脑室管膜细胞是有丝分裂后的,不能作为神经干细胞发挥作用。为了揭示脊髓和脑室管膜细胞之间差异,文章将成年,老年小鼠室管膜数据与已发表的中枢神经系统室管膜细胞转录组数据整合。

成熟脊髓室管膜细胞表达的Sntn和其他基因,脑室管膜细胞几乎都表达。又因为小鼠大脑中的室管膜细胞在出生后前两周完成熟,进一步支持Sntn标记成熟室管膜细胞的观点(图4C)。脑和脊髓室管膜细胞也表现出明显的分子差异。Wnt/β-连环蛋白信号在脊髓室管膜细胞增殖中起关键作用,然而脑室管膜细胞特异表达Sfrp1(一种阻断Wnt配体与其受体之间相互作用并维持室管膜下区静止状态的分泌蛋白)。解释了大脑和脊髓室管膜细胞成熟和增殖能力差异的潜在解释。文章还在脊髓室管膜细胞中鉴定了在中央管中具有不同的信号传导能力的基因(包括生长因子Hbegf及其潜在受体酪氨酸激酶Erbb4)。这些结果强调在脊髓中维持一个更动态的信号微环境。文中提出脊髓中央管内成熟状态的范围决定了该细胞群对损伤的反应能力,而随着细胞的成熟,这种能力会丧失。
5、受伤脊髓中外侧室管膜细胞成熟是可逆的
为了测试成熟的脊髓室管膜细胞是否代表终末分化的细胞状态,文章从5个月大的小鼠中生成脊髓切片(完整的脊髓切片0天,培养3天和5天),探索表达Sntn的细胞的增殖情况。文章将Sntn的RNAscope和室管膜富集基因Mia与细胞增殖标记Ki67的免疫荧光相结合。

完整的脊髓中,25%室管膜细胞表达Sntn。3天后,室管膜细胞增殖急剧增加,而表达Sntn的细胞的比例显著下降(图5B,C)。这表明要么表达Sntn的细胞在损伤后优先丢失,要么尽管表达了这种成熟的细胞标志物,但这些细胞仍然是可塑性的并且可以下调Sntn。接着发现培养3天的脊髓切片中低水平表达Sntn细胞的百分比高于完整脊髓,而且大多数Ki67阳性室管膜细胞是Sntn阴性的,没有发现表达高水平Sntn的细胞在受伤的脊髓中增殖(图5C)。在培养5天的脊髓切片中,表达Sntn的细胞和增殖细胞的百分比恢复接近正常条件。这些发现表明,Sntn的表达在一些不是全部成熟的外侧室管膜细胞中是动态调节的。
为了评估体外室管膜细胞是否与体内脊髓损伤后观察到的室管膜细胞反应一致,相同年龄段体内标记室管膜细胞,结果与体外一致(图5E)。
6、成年人类脊髓中的室管膜细胞表达SNTN并随着年龄的增长而改变其身份
为了确定小鼠中的发现与人类的相关性,文章研究了不同年龄段的人类脊髓样本中的SNTN表达。使用FOXJ1免疫荧光来鉴定室管膜细胞,并使用RNAscope检测SNTN的表达。SNTN在检查的所有人类脊髓样本中广泛表达(图6A)。

接下来检测表达ZIC1的背侧和表达ARX的腹侧细胞的转录本。人类胚胎脊髓中ZIC1和ARX表达结构域都受到限制(图7A,B)。相比之下,作者发现所有成年的ZIC1和ARX结构域几乎互补,大多数室管膜细胞表达ARX,一小部分表达ZIC1;尤其从30岁开始,ZIC1表达变少,大多数室管膜细胞一致地表达ARX(图6B)。为了进一步探索人类室管膜细胞的这种明显的腹侧化,文章分析了另一种腹侧标志物FOXA2和外侧室管膜细胞标志物PAX6的表达。在胚胎脊髓中,细胞共表达ARX和FOXA2(图7B)。然而,在成人脊髓中,大多数室管膜细胞共表达ARX和PAX6(图6C,D)。这些发现表明成人脊髓中室管膜细胞特性的变化,大多数细胞共表达腹侧和外侧基因ARX和PAX6。

结论
文章将小鼠室管膜细胞分为背侧,腹侧和外侧细胞亚型。脊髓室管膜细胞与脑室管膜细胞相比,许多外侧室管膜细胞持续处于未成熟的细胞状态。将细胞成熟状态的范围与室管膜细胞对损伤的反应能力联系起来,发现侧室管膜细胞成熟是可逆的。然而,细胞成熟的逆转是短暂的,细胞迅速重建成熟的细胞状态并恢复到细胞增殖的基础水平。与小鼠形成鲜明对比的是,人类脊髓中的大多数室管膜细胞表达成熟细胞标志物SNTN,并且共同表达外侧和腹侧细胞标志物PAX6和ARX。这项研究提供了一种资源,可以揭示不同室管膜细胞亚型驱动脊髓修复的潜力,并强调细胞成熟的调节是哺乳动物对损伤反应的关键机制。
参考文献
Albors A R, Singer G A, Llorens-Bobadilla E, et al. An ependymal cell census identifies heterogeneous and ongoing cell maturation in the adult mouse spinal cord that changes dynamically on injury[J]. Developmental Cell, 2023. http://doi.org/10.1016/j.devcel.2023.01.003.
供稿:生信与数据中心
审核:市场支持中心
