冰熔化成水时的密度变化
今天,有朋友问我,为什么“冰的密度比水的密度小?”
一、T和P影响着物质的密度
其实这个朋友的问题提的似乎不太标准,因为 \rho=\frac{m}{V} ,而 V 又受到 T,P 等因素的影响,因此在讨论物质的密度时,必须给定T,P 以限定。
① T 增大,由于分子的热运动加剧,分子间距离变大,因此物质的体积增大, \rho 变小;
② P 增大,分子需克服外界的压强,分子间距离变小,因此物质的体积减小, \rho 变大。
所以“冰的密度比水的密度小”这个比较应该给一个对 T,P 的限定条件。
二、H_{2}O 的密度与温度的关系
我想,这位朋友之所以提出这个问题,应该是注意到了这个事实:0℃时, H_{2}O 的密度为 0.99987g·cm^{-3} ,但在0~4℃时,H_{2}O 的密度却逐渐增大(如图1),在4℃时达到最大值(1.00000g·cm^{-3} ),在4℃以上,H_{2}O 的密度又逐渐减小,在8℃左右,H_{2}O 的密度为0.99985g·cm^{-3},与0℃时的密度近似相等。

也就是说,在0~4℃时,H_{2}O 的密度有些反常,明明“热胀冷缩”,温度升高,密度应该变小,但H_{2}O 的密度却反常地增大。
我想,这位朋友想问的应该是“为什么0℃的冰比0~8℃区间内的水密度小?”或者说“为什么0~4℃区间内,H_{2}O 的密度反常地增大(热缩冷涨)?”
三、H_{2}O的分子结构
在H_{2}O 分子中,O原子采取 sp^{3} 杂化,4个杂化轨道中,有2个排布着单电子的杂化轨道与H原子的1s轨道形成 \sigma键,而剩余的2个杂化轨道,排布着2对孤电子对。这4对电子在空间排布成“四面体构型”(如图2)。

四、H_{2}O分子之间的作用力
水分子之间既存在着范德华力,也存在着氢键
1.范德华力
范德华力是所有分子之间共有的作用力,个人认为,它有点类似于宏观物体的“万有引力”。
当然这是一种简单的理解,二者并不能等同。因为微观粒子之间,既有引力,也有斥力,我们要研究的应该是引力与斥力的合力(如图3),仅在分子间距 d>r_{0}时,合力才体现为引力,并且随着 d 的增大,引力逐渐减弱。

而由于分子间距 d 一般都比 r_{0} 大,所以我们常说“温度越高,分子间距离越大,分子间引力越小”。那么就不难理解热胀冷缩的原因了(随着温度的升高,分子间作用减弱,分子距离增大,物质体积增大,密度减小)。
2.氢键
之所以水在0~4℃时热缩冷涨,实际上是由于水分子之间形成了一种特殊的相互作用,即氢键。
(1)氢键的形成:
由于O的电负性很大,因此O-H键具有强极性,导致成键电子对强烈地偏向于O原子,而H原子则变成了一个“裸露的核”。也即 H_{2}O 分子中,H原子因成键电子对的偏移具有很强的正电性,而O原子因孤电子对的存在和成键电子对的偏移具有很强的负电性(如图4)。
在水中,上述的H_{2}O 分子比比皆是,难免使一个水分子中呈正电性的H原子与另一个水分子中O原子上的孤电子对相互接触,并形成静电引力,这就是氢键。

(2)氢键的特征:氢键的两大特征是具有方向性和饱和性。
以 H_{2}O 分子的氢键为例(如图5),由于氢键是①号水分子中的H与②号水分子中O原子的孤电子对形成的,因此,成键就具有方向性,这是H2O分子的结构导致的,上文提到,H_{2}O 中4个电子对(2个成键电子对和2个孤电子对)之间都存在着接近109.5°的角度,并在空间排布成四面体结构,那么①号水分子中的H想与②号水分子中的O形成氢键,就必须沿着②号水分子O上的孤电子对的方向去“碰撞”,这就是氢键的方向性。
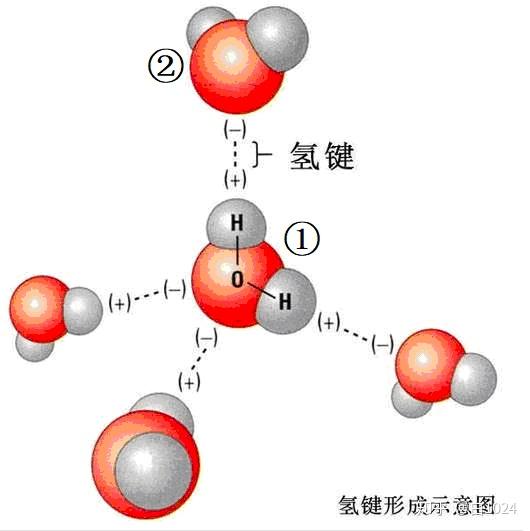
正是由于氢键的方向性,当一个H原子形成了一个氢键以后,就无法再沿着其它方向与其它O原子形成氢键,这就是氢键的饱和性。
(3)H_{2}O分子氢键的空间特点:
根据上述讨论,1个H_{2}O分子最多沿4个不同方向形成4个氢键(其中2个是H原子与其它O原子形成的,还有2个是O原子上的孤电子对与其它H原子形成的),这4个氢键在空间形成了四面体的结构。
那么可以想象,在冰中,以一个水分子为中心,其氢键向四面体的四角逐渐发散,可以形成空间立体网状结构,这个网状结构是以小四面体为结构单元延伸的。
五、冰的晶胞
冰是H_{2}O的晶体形式,既然是晶体,那么冰在微观上就一定具有周期性重复排列的结构单元,也就是晶胞。
刚才叙述了,在冰中,存在着以诸多小四面体为单元的重复结构,这跟金刚石很相似,实际上,冰的晶胞确实跟金刚石的晶胞非常相似(如图6),不同之处在于:第一,冰晶胞中的粒子是H_{2}O分子,而金刚石晶胞中则是C原子,第二,冰晶胞中的堆积作用力是氢键和范德华力,而金刚石晶胞中则是 C-C \sigma 键。

通过晶胞的图片,可见,冰晶胞的配位数为4,空间利用率确实不大,在晶胞中存在着很多“镂空结构”,这是氢键的方向性所要求的。
六、冰熔化为水时微观结构的改变
不得不说一下晶体的概念,我们常说的物质具有固、液、气三态,而固体又根据微观上是否存在按一定规则有序排列的结构分为晶体和非晶体。但是,液体和气体中的微粒都可以自由移动,显然没有规则,所以不是晶体。
冰是H_{2}O的晶体,那么在冰熔化成水时,就势必造成原本有规则的空间结构,变得杂乱无章,这个过程实际上是一部分氢键破坏导致的。
也就是说,原本的冰晶体中,各H_{2}O分子依靠氢键堆积,形成了十分规则的微观结构,但是在冰熔化时,由于温度地升高,H_{2}O分子运动加剧,导致这个“必须按照一定方向、一定位置才能形成的”氢键被破坏掉。
随着氢键的破坏,大的缔合水分子逐渐瓦解,变为三分子缔合水分子、双分子缔合水分子或单个水分子。这些小的缔合水分子或单个水分子,受氢键的影响较小,可以任意排列和运动,不必形成“镂空结构”,而且单个水分子还可以“嵌入”大的缔合水分子所形成的“镂空结构”中间。
七、水的密度随温度的变化
在水温升高的过程中,要分析其密度的变化,应从两个角度进行探讨。
一方面,单个水分子在水中的比例逐渐加大,有的“单个水分子”嵌入大的缔合水分子中间,导致空间利用率升高,水的宏观体积减小,水的密度也随之增大。
另一方面,在这个过程中,随着温度的升高,水分子的运动速度加快,使得分子的平均距离加大,水的密度随之减小。

可见,上述两个因素是互相对抗的,因此考虑水密度随温度变化的规律时,应当综合考虑两种因素的影响。
在温度为0~4℃时,由缔合水分子氢键断裂引起水密度增大的作用,比由分子热运动速度加快引起水密度减小的作用更大,所以在这个过程中,水的密度随温度的增高而加大,这就是水的反常膨胀(如图7)。
